İNSTAGRAM @ bilgilimiti sayfasını takip edebilirsiniz
Elektron Dizilimleri
Bir atomun elektron dizilişi, elektronların orbitallere nasıl yerleşeceğini gösterir. Elektronların orbitallere yerleşimindeki sıra, spektroskobik ve manyetik yöntemlerle ortaya çıkarılmıştır. Bunun sonucunda bir yerleşim sırası kurgulanmıştır.
Elektronların orbitallere dolması şu sıra ile gerçekleşir:
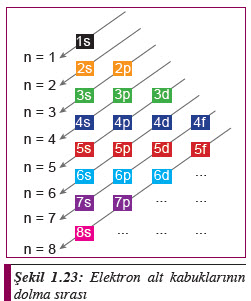
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p 8s
Elektronların orbitallere yerleşim sırasının akılda tutulabilmesi için Şekil 1.23’te gösterilen yaklaşım faydalı olacaktır.
Wolfgang Pauli (Volfgeng Poli), 1926 yılında atomlara ait yayılma spektrumlarının karmaşık yapısını açıklarken bir atomda bütün kuantum sayıları aynı olan iki elektronun var olamayacağını savunmuştur. Pauli Dışlama İlkesi diye adlandırılan bu ilkeye göre bir orbitalde yalnızca iki elektron bulunabilir ve bu elektronlar zıt spinlere sahip olmalıdır. Buna göre alt kabuklara yerleşebilecek elektron sayıları; s için en çok 2 elektron, p için en çok 6 elektron, d için en çok 10 elektron ve f için en çok 14 elektrondur. Bu sonuca göre elektron sayılarının orbital sayılarının iki katı olduğu görülmektedir.
Elektron dizilişinde, bir atom olabildiğince çok sayıda eşleşmemiş elektrona sahip olmak ister. Bu durum Hund Kuralı olarak bilinir. Bu kurala göre elektronlar orbitallere öncelikle birer birer yerleşir (paralel spinli).
Elektron dağılımını yazmada Almanca “inşa etme” anlamına gelen aufbau (aufba) işlemini kullanacağız.Bu işlem, atom numarası artarken elektron dağılımının nasıl “inşa” edileceğini gösterir. Atomların elektron dizilişleri; periyodik sistemin, elementlerin periyodik özelliklerinin ve atomlarının kimyasal bağ oluşturma yatkınlıklarının belirlenmesinde önemli bir anahtardır.
Bir atomun, temel hâl elektron dizilişindeki en son orbitalinin tam dolu ya da yarı dolu olması, atoma küresel simetri durumu kazandırır. Bu durumdaki atom daha kararlıdır. Çünkü küresel simetri özelliği gösteren atomlarda elektronlar çekirdek tarafından simetrik olarak (eşit kuvvetle) çekilir. Çekirdek tarafından simetrik çekilen elektronu koparmak için dışarıdan verilmesi gereken enerji değeri daha büyük olur.
ELEKTRON İLGİSİ
Gaz hâlindeki bir atomun bir elektron alarak anyon oluşturması sırasındaki enerji değişimine elektron
ilgisi denir.
F(g) + e– F–(g) E İ = –328,2 kJ/mol
Yukarıdaki tepkimede bir elektron, flor atomunun + yüklü çekirdeği tarafından çekileceği için atom,
negatif iyon durumuna geçer ve reaksiyon ekzotermiktir. Enerji değişimi iyonlaşma enerjisinde olduğu
gibi elektron ilgisinde de atom büyüklüğündeki değişmeye paralellik gözlenir. İyonlaşma enerjisinin aksine elektron ilgisinin ölçülmesi, pek çok elementin anyonunun kararlı olmaması nedeniyle zordur.
İYONLAŞMA ENERJİSİ
İE1, gaz hâlindeki nötr bir atomdan bir elektron uzaklaştırabilmek için gereken enerjiyi gösteren birinci
iyonlaşma enerjisidir. İE2, gaz hâlinde (+1) değerlikli bir iyondan ikinci elektronu uzaklaştırmak için gerekli enerjiyi gösterir ve ikinci iyonlaşma enerjisi adını alır. Bir atomun iyonlaşma enerjileri İE1 < İE2 < İE3 < … olarak değişir. İyonlaşma her zaman endotermik (ısı alan) bir olaydır.
İyonlaşma enerjisinin tanımında atomun gaz hâlinde olduğu vurgulanmıştı. Bunun nedeni, iyonlaşma enerjisi ölçülürken gaz atomlarının komşularından etkilenmemeleri ve moleküller arası etkileşmelerin
(moleküller arası kuvvetlerin) ihmal edilebilir olmasıdır.
Bazı istisnalar hariç, bir periyottaki elementlerin birinci iyonlaşma enerjileri atom numarası arttıkça
artmaktadır. Bunun nedeni ise soldan sağa gidildikçe çekirdek yükünün artmasıdır. Çekirdek yükünün
artması, en dış elektronun çekirdek tarafından daha sıkı tutulması anlamına gelir ki bu da birinci iyonlaşma enerjisinin artmasına neden olur. Asal gazlarda ise bu değer tepe noktasına ulaşır. 1s2 elektron dizilimine sahip olan Helyum, bütün elementler arasında birinci iyonlaşma enerjisi en yüksek olan elementtir.
Elektronegatiflik (EN)
Elektronegatiflik, Linus Pauling (Laynıs Polink) tarafından bir atomun, ortak olduğu kimyasal bağdaki
elektronu çekme gücünün bir ölçüsü olarak ortaya atılmıştır. Pauling, elektronegatiflik için bağ ayrışma
enerjileri cinsinden uygun bir sayısal ölçeğin tanımlanabileceğini ileri sürmüş ve elektronegatiflik listesini oluşturmuştur . Pauling listesinde elektronegatiflik değerleri 0,7 ile 4,0 arasında değişir.
Periyodik Sistemde Elementlerin Asitlik ve Bazlık Özelliklerinin Değişimi
Periyodik sistemin 3. periyot elementlerinin asitlik ve bazlık özelliklerindeki değişim ele alındığında
bu elementlerin oksit bileşiklerinin asitlik ve bazlık değişimi için genellemeler yapılabilir (Burada merkez atomun en yüksek değerlikte olduğu oksitler ele alınacaktır.).
Na2O MgO Al2O3 SiO2 P4O10 SO3 CI2O7
Oksitler, suda çözündüklerinde H+ veya OH– iyonu derişimlerini artırmalarına göre asidik ya da bazik
olarak sınıflandırılır. Bazı oksitler ise hem asidik hem de bazik özellik gösterdiklerinden amfoterdir
YÜKSELTGENME BASAMAĞI
Kimyasal değişimlerde, atomda bulunan artı yüklü protonların sayısı değişmezken eksi yüklü elektronlar azalır veya artar. Nötr bir atom bir ya da daha fazla sayıda elektron kaybedip pozitif yüklü iyon hâline gelebilir, pozitif yüklü bu iyona katyon denir. Na+, Mg2+ ve Fe3+ katyonlara örnek verilebilir. Nötr bir ametal atomu ise elektron sayısındaki artış nedeniyle yükü eksi olan iyon durumuna geçebilir, negatif yüklü bu iyona anyon denir. CI–, S2– ve P3– iyonları da birer anyondur.
Serbest element atomunun yükseltgenme basamağı sıfırdır. (Cl 2 , Fe, O 2)
Bileşiklerde tüm atomların yükseltgenme basamaklarının toplamı sıfırdır.
1A grubu elementleri (1+), 2A grubu elementleri (2+), 3A grubu elementleri (3+) yükseltgenme
basamağına sahiptir.
Hidrojen, bileşiklerde genellikle (1+) yükseltgenme basamağına sahiptir. Metal hidrürlerinde
(NaH gibi) ise (1–) yükseltgenme basamağındadır.
Oksijen, bileşiklerde (2–) yükseltgenme basamağını alır. Peroksitlerde (Na2O2 gibi) (1–)’dir.
OF2 bileşiğinde ise (2+)’dır.
7A grubu, 6A grubu ve 5A grubu elementleri, metallerle yaptığı ikili bileşiklerde sırasıyla (1–),
(2–) ve (3–) yükseltgenme basamaklarına sahiptir.
7A grubu elementlerinden sadece flor her zaman (1–) yükseltgenme basamağındadır. Diğer
7A grubu elementleri (1–)’in yanı sıra (3+), (5+), (7+) gibi yükseltgenme basamaklarında da bulunabilir.
UYARI: d-bloku elementleri, bileşik oluşturduklarında öncelikle s orbitallerindeki değerlik elektronlarını kaybeder. İlave olarak çoğu farklı sayıda d orbitallerindeki elektronlarını da verir ve değişik sayıda yükseltgenme basamağına sahip olur.
İyonik Bileşikler
İyonik bileşiklerin katyon ve anyonlardan oluştuğunu biliyoruz. Amonyum iyonu (NH+4) dışında incelediğimiz tüm katyonlar metal atomlardan kaynaklanır. Bu nedenle iyonik bileşikler adlandırılırken önce metal katyonun adı, sonra da ametal anyonun adı verilir. Buna göre NaF bileşiğinin adı sodyum florürdür. Ametal adının sonuna “ür” ekinin getirildiğine dikkat ediniz.
Metal adı + ametal adı + “ür” eki
İyonik bileşiklerin formüllerinin yazılmasında katyon ve anyonların yüklerinin bilinmesi önemlidir.
Kovalent Bileşikler
İyonik bileşiklerden farklı olarak kovalent bileşikler belirli ve bağımsız molekül birimleri içerir.
Ametallerden oluşan moleküllerin yani kovalent bileşiklerin adlandırılmasında elementlerin atom sayısı, sayı ön ekleri ile belirtilir. Kovalent bileşiklerin adının sonuna “ür” ekinin getirildiğine dikkat ediniz. İyonik bileşiklerin adlandırılmasında bahsedildiği gibi kovalent bileşiklerin adlandırmasında da ametal oksijense “oksit”, kükürtse “sülfür”, azotsa “nitrür” olarak adlandırılır.
Sayı ön eki + ametal adı + sayı ön eki + ametal adı – “ür” eki
- Birinci element için “mono” ön eki kullanılmaz.
Örneğin PF3 bileşiği, monofosfor triflorür yerine fosfor triflorür diye adlandırılır.
- Oksitler adlandırılırken bazen ön ekteki “a” atlanır.
Örneğin N2O4, diazot tetraoksit yerine diazot tetroksit diye adlandırılır.
- Oksitler adlandırılırken bazen de ön ekteki “o” atılır.
Örneğin CO, karbonmonooksit yerine karbonmonoksit diye adlandırılır.
H2O : Su H2SO4 : Zaç yağı
CaCO3 : Kireç taşı HCOOH : Karınca asidi
HCI : Tuz ruhu Na2CO3 : Çamaşır sodası
NaCI : Yemek tuzu PH3 : Fosfin
KOH : Potas kostik Ca(OH)2 : Sönmüş kireç
KNO3 : Güherçile CH3COOH : Sirke asidi
NH3 : Amonyak NaOH : Sud kostik
CaO : Sönmemiş kireç CH4 : Metan